FRAGMENTOS DE OKAZAKI
Los fragmentos de Okazaki son secuencias cortas de nucleótidos de ADN (aproximadamente de 150 a 200 pares de bases de largo en eucariotas ) que se sintetizan de forma discontinua y luego se unen mediante la enzima ADN ligasa para crear la hebra retrasada durante la replicación del ADN . Fueron descubiertos en la década de 1960 por los biólogos moleculares japoneses Reiji y Tsuneko Okazaki , junto con la ayuda de algunos de sus colegas.
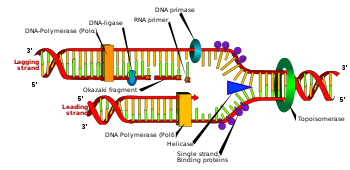
Durante la replicación del ADN, la doble hélice se desenrolla y las hebras complementarias son separadas por la enzima ADN helicasa , creando lo que se conoce como horquilla de replicación del ADN . Después de esta bifurcación, la ADN primasa y luego la ADN polimerasa comienzan a actuar para crear una nueva hebra complementaria. Debido a que estas enzimas solo pueden trabajar en la dirección 5 'a 3', las dos hebras de plantilla desenrolladas se replican de diferentes maneras. Una hebra, la hebra principal , se somete a un proceso de replicación continuo ya que su hebra plantilla tiene una direccionalidad de 3 'a 5', lo que permite que la polimerasa que ensambla la hebra principal siga la bifurcación de replicación sin interrupción. Sin embargo, la hebra rezagada no se puede crear de manera continua porque su hebra plantilla tiene una direccionalidad de 5 'a 3', lo que significa que la polimerasa debe trabajar hacia atrás desde la horquilla de replicación.

EXPERIMENTOS

Función biológica

TZUNEKO OKAZAKI
Tsuneko Okazaki (岡崎 恒子? 7 de junio de 1933) es una científica japonesa conocida por descubrir e investigar los fragmentos de Okazaki, junto con su marido Reiji Okazaki.1
Los fragmentos de Okazaki han contribuido a explicar la replicación del ADN. La doctora Okazaki ha continuado su relación con la academia, contribuyendo con más avances en la investigación del ADN.
Graduada en la Universidad de Nagoya en 1956, Tsuneko Okazaki fue la primera mujer profesora en la universidad japonesa de Nagoya, y actualmente es profesora en el Instituto Médico de la Universidad Fujita. En el año 2000 recibió el Premio L'Oréal-UNESCO a Mujeres en Ciencia, que se concede anualmente a cinco científicas distinguidas, una por cada continente.
DESCUBRIMIENTO EN LOS FRAGMENTOS DE OKAZAKI
Las primeras investigaciones de Tsuneko y Reiji Okazaki se centraban en la síntesis de del ADN y las características de nucleótidos característicos en huevos de rana y erizos de mar. Este trabajo les llevó a descubrir el nucleósido timidina-difosfato rhamnosa, descubrimiento que les abrió las puertas a poder trabajar en los Estados Unidos. Trabajaron en las universidades de Washington y Stanford en los laboratorios de J. L. Strominger y Arthur Kornberg, respectivamente, donde disponían de muchos más recursos para continuar con sus trabajos. Años más tarde, tras largas investigaciones en EE. UU. y Japón, en 1968, Tsuneko y Reiji publicaron sus impactantes descubrimientos sobre los fragmentos de Okazaki en la revista Proceedings of the National Academy of Sciences of the United States of America. Tras la temprana muerte de su marido en 1975 (debida a la leucemia que le provocó la bomba de Hiroshima), Tsuneko continuó con sus estudios y avances en demostrar la estructura del primer de ARN asociado a los fragmentos de Okazaki.
¿Para qué sirven los fragmentos de OKAZAKI?
¿Cómo se forman los fragmentos de OKAZAKI?
Toda la información en este video:
https://www.youtube.com/watch?v=Z4CFTlxg3I4
REDOX - METODO CIENTIFICO
Redox es el nombre que recibe una reacción de tipo químico que implica la transferencia de electrones entre distintos reactivos, lo que lleva a una modificación del estado de oxidación. En estas reacciones, un elemento pierde electrones y el otro, los recibe.
El término redox refiere a la REDucción-OXidación que se da en el marco de la reacción. Hay un elemento que acepta los electrones que libera el otro y que se reduce al producirse una minimización de su estado de oxidación. El elemento que se encarga de la liberación de los electrones, por su parte, se oxida. Mientras que el elemento que gana electrones se conoce como agente oxidante, el elemento que los libera recibe el nombre de agente reductor.
TIPOS COMUNES DE REACCIONES REDOX
Debido a que las reacciones redox son una clase importante de reacciones, queremos ser capaces de reconocerlas. Hay algunos tipos especiales de reacciones redox con las que deberías familiarizarte. Para cada uno de estos ejemplos, tómate un minuto para averiguar qué se está reduciendo y qué se está oxidando.1, point, spaceReacciones de combustiónUna reacción de combustión es una reacción redox entre un compuesto y una molécula de oxígeno (start text, O, end text, start subscript, 2, end subscript) para formar productos que contienen oxígeno. Cuando uno de los reactivos es un hidrocarburo, los productos incluyen dióxido de carbono y agua. La siguiente reacción es la combustión del octano, un hidrocarburo. El octano es un componente de la gasolina y su reacción de combustión sucede en el motor de la mayoría de los automóviles:
2, point, spaceReacciones de desproporciónUna reacción de desproporción (o reacción de dismutación) es una reacción en la que un solo reactivo se oxida y se reduce al mismo tiempo. La siguiente reacción es la desproporción del hipoclorito, start text, C, l, O, end text, start superscript, minus, end superscript:Si analizamos los números de oxidación del cloro, podemos notar que el reactivo start text, C, l, O, end text, start superscript, minus, end superscript está siendo oxidado a start text, C, l, O, end text, start subscript, 3, end subscript, start superscript, minus, end superscript (donde el número de oxidación incrementa de plus, 1 a plus, 5). Al mismo tiempo, el cloro de otras moléculas de start text, C, l, O, end text, start superscript, minus, end superscript está siendo reducido a start text, C, l, end text, start superscript, minus, end superscript (donde el número de oxidación disminuye de plus, 1 a minus, 1). El oxígeno tiene un número de oxidación de minus, 2 tanto en start text, C, l, O, end text, start superscript, minus, end superscript como en start text, C, l, O, end text, start subscript, 3, end subscript, start superscript, minus, end superscript, así que no se oxida ni se reduce en la reacción.
3, point, spaceReacciones de desplazamiento simpleUna reacción de desplazamiento simple (o reacción de sustitución simple) sucede cuando dos elementos intercambian lugares en un mismo compuesto. Por ejemplo, muchos metales reaccionan con ácidos diluidos para formar sales e hidrógeno en forma gaseosa. La siguiente reacción muestra al zinc reemplazando el hidrógeno en una reacción de desplazamiento entre el metal zinc y el ácido clorhídrico en forma acuosa:
¿PORQUE SE DA LA ACIDEZ ESTOMACAL?
LA QUIMICA DE LA ACIDEZ DE ESTOMAGO
La química tiene algo que decir a este respecto….
Cuando ingerimos alimentos, éstos llegan al estómago y se mezclan con los jugos gástricos, que son una disolución de ácido clorhídrico (al 1% aproximadamente, lo que le confiere un pH en torno a 0,8), sales (como cloruro sódico, NaCl, y cloruro potásico, KCl) y enzimas digestivas en forma inactiva, principalmente pepsinógeno, que es el precursor de la pepsina. Los jugos gástricos son segregados por las numerosas glándulas parietales microscópicas distribuidas por toda la mucosa estomacal, gracias a la acción de una hormona, la gastrina, que se activa cuando llega comida al estómago.
El ácido clorhídrico segregado en el estómago posibilita que el pepsinógeno inactivo se hidrolice, desprendiéndose de algunos aminoácidos para formar la pepsina, forma activa de la enzima. La pepsina es una enzima capaz de hidrolizar proteínas (es decir, de romper enlaces peptídicos). El enlace peptídico es un enlace entre el grupo amino (–NH2) de un aminoácido y el grupo carboxilo (–COOH) de otro aminoácido. La pepsina únicamente rompe los enlaces peptídicos formados entre fenilalanina y fenilalanina y entre fenilalanina y tirosina.
Así, las proteínas que ingresan al estómago se convierten en péptidos (cadenas cortas formadas por unos pocos aminoácidos) o aminoácidos sencillos, en función de la proteína ingerida. La pepsina es una enzima especial, ya que es más activa a un pH de entre 2 y 3, que es el valor de pH que toma el estómago tras la ingestión de alimentos. Por encima de pH 5 se inactiva, mientras que la mayoría de enzimas lo hacen a pH ácido. La digestión, por tanto, requiere necesariamente una concentración alta de protones, H+, en el estómago.
Sin embargo, a veces, cuando comemos en exceso o ingerimos alimentos muy pesados (cafeína, alcohol, cítricos, encurtidos, vinagre, embutidos, carnes rojas…), los niveles ácidos del estómago se descompensan, sentimos esa molesta acidez y debemos recurrir a un antiácido. Un antiácido no es otra cosa que un compuesto químico que, actuando como base reacciona con el exceso de ácido (protones) del estómago, generando una reacción de neutralización.
La reacción general de neutralización del ácido estomacal con un antiácido se puede expresar como:
HCl (ácido gástrico) + Antiácido (base débil) →
H2O + CO2 + sales conjugadas
La cantidad de CO2 dependerá del antiácido que estemos utilizando; en concreto, se generará dióxido de carbono si usamos bicarbonato o carbonato, lo cual provocará los molestos eructos. Veamos esas reacciones de neutralización:
NaHCO3 + HCl→ NaCl + CO2 + H2O
CaCO3 + 2 HCl → CaCl2 + CO2 + H2O
Existen otros antiácidos que no producen CO2, tales como el hidróxido de aluminio y el hidróxido de magnesio:
3 HCl + Al (OH)3 → AlCl3 + 3 H2O
Mg(OH)2 + 2 HCl → MgCl2 + 2 H2O
Sin embargo, aunque estos otros antiácidos no producen CO2, y por lo tanto se evita tener los incómodos eructos anteriormente citados, tienen una contrapartida y es que sus productos de neutralización al usar sales de calcio o de aluminio, pueden provocan estreñimiento, y las de magnesio, por el contrario, pueden tienen efectos laxantes.
Por ello, otro antiácido muy utilizado es la combinación del hidróxido de aluminio y de magnesio, que contrarresta en parte estos efectos laxantes y de estreñimiento, es el conocido almagato, cuya reacción de neutralización es:
Al2Mg6(OH)14(CO3)2 + 18 HCl → 2 AlCl3+ 6 MgCl2+ 2 CO2 + 16 H2O
PROBLEMAS DE OXIDO-REDUCCION
El FeO.H 2O que se forma se sigue oxidando con el oxígeno (O 2) disuelto en el agua, y forma un óxido férrico u óxido de hierro (III) hidratado:
2FeO.H 2 O(s) + O2(AC) + 2H 2 O(l) 2Fe 2 O 3.3H 2 O(s)
Para evitar el proceso de corrosión se utilizan capas protectoras protectoras de otro metal como el estaño, estaño, recubriendo al metal con pintura o realizando la galvanización. Los metales que no puedan pintarse o galvanizarse como los oleoductos y tanques de almacenamientos enterrados, a menudo se protegen de la corrosión mediante ánodos de sacrificio, que son pedazos de reactivos como el zinc y el magnesio, conectados al objeto que se va a proteger mediante un conducto.
Protección Protección de un oleoducto oleoducto con un ánodo de sacrificio. El alambre de zinc tiene un diámetro de 0.5[in] y se conecta a la tubería a intervalos aproximados de 1824[in] a 3660[in]. Como el zinc se óxida más fácilmente que el hierro, se produce la reacción siguiente: Zn(s) Zn2+ + 2e, los electrones reducen al oxígeno: O2(g) + 2H2O(l) + 4e evitando que la tubería de hierro se oxide.
Protección Protección de un oleoducto oleoducto con un ánodo de sacrificio. El alambre de zinc tiene un diámetro de 0.5[in] y se conecta a la tubería a intervalos aproximados de 1824[in] a 3660[in]. Como el zinc se óxida más fácilmente que el hierro, se produce la reacción siguiente: Zn(s) Zn2+ + 2e, los electrones reducen al oxígeno: O2(g) + 2H2O(l) + 4e evitando que la tubería de hierro se oxide.





Me pareció muy interesante este tema y de la misma manera me a servido de mucho.... GRACIAS!! 🕺🏼❤️
ResponderBorrarGracias por tu apoyo, sígueme para mas contenido útil
BorrarMe puede pasar su contacto para poder ponernos de acuerdo para más información???
BorrarEn efecto, desearía que me contacte en mi e-mail : luismurminacho@hotmail.com
BorrarMuy bueno su blog amigo, me ayuda a informarme mas sobre varias alteraciones en los fragmentos. MUY BUENO SU CONTENIDO.
ResponderBorrarMuy buen blog me sirvió de mucho gracias por tu ayuda
ResponderBorrarMuy buen trabajo, bastante interesante de este tema que de la alteracion de los fragmentos que es un tema muy completo, me sirvio mucho esta informacion
ResponderBorrarMuy bien detallado el trabajo se nota el tiempo que se dedicó mucho tiempo para hacer el blog
ResponderBorrarMi estimado cadete lucho, me acerco a felicitarle por su excelente trabajo de la asignatura de biología, con mi estimado licenciado magister Santiago Fiallos, saluditos a la distancia 💜
ResponderBorrarBuen dato
BorrarLa información muy detallada y concisa para la investigación, buen trabajo siga así
ResponderBorrarMe parece interesante tu blog, ya que da a conocer muchas características e ideas .
ResponderBorrarMe parece importante lo aprendido sobre este tema y es muy interesante
ResponderBorrar